수처리제를 사용한 철제유물의 부식 안정성 연구
Corrosion Stability of Iron Artifacts after Treating with Water Treatment
Article information
Abstract
철제유물의 안정화처리는 탈염을 중점으로 하고 있으나, 부식인자 제거여부의 불확실성과 일부 유물의 제한적 적용 등으로 재부식과 같은 문제점이 지적되고 있다. 이를 보완하기 위한 부식억제제의 연구는 일부 보고된 바 있으며, 이 연구는 부식억제를 위한 수처리제 3종에 대한 연구결과이다. 부식억제제 피막이 형성된 시편의 표면관찰 결과 인산염 이 주성분인 1종 2호의 시편은 표면의 녹층이 제거되었고, 재부식 시편의 중량 감소율 평균은 1종 2호의 경우 0.58%, 2종 2호의 경우 0.03%, 3종 2호의 경우 0.07%이며, 부식인자인 Cl- 이온의 변화량은 1종 2호는 28.60 ppm, 2종 2호는 –4.08 ppm, 3종 2호는 –1.94 ppm이었다. 수처리제의 피막에 대하여 XPS로 표면상태를 분석한 결과, 3종 2호보다 2종 2호에서 소지금속인 Fe가 낮게 검출되어 다소 우수한 피막을 유지하였고, Si함량에서도 규산염 기반의 2종 2호에서 상대적으로 함량이 높아 피막 형성이 우수하다고 판단된다. 인산염을 주성분으로 한 1종 2호는 표면의 녹층을 제거하여 금속유물 보존처리약품으로 부적합하고, 규산염을 주성분을 한 2종 2호와 3종 2호의 수처리제는 부식억제 효과가 우수 하다고 평가된다. 부식억제제는 철제유물의 출토 당시에 긴급하게 사용할 수 있는 약품으로도 활용이 가능할 것이다.
Trans Abstract
Desalination is the main focus of the stabilization of iron artifacts. However, drawbacks such as re-corrosion are noted due to the uncertainty in the elimination of the corrosive factors and artifacts. Several studies have been carried out on the effects of corrosion inhibitors to overcome these shortcomings. In this study, the effects of type 3 water treatment on corrosion inhibitors were investigated. Surfaces of samples that contained film corrosion inhibitors on their surfaces were analyzed. The results revealed that the surface rust was removed from the sample of type 1 No. 2 that was mainly composed of phosphate. The average weight reduction rates of re-corrosion samples were 0.58, 0.03, and 0.07% for type 1 No. 2, type 2 No. 2, and type 3 No. 2 respectively. The changes in the Cl- ion, a corrosive agent were found to be 28.60, -4.08, and -1.94 ppm for type 1 No. 2, type 2 No. 2, and type 3 No. 2 respectively. The water-treated films were analyzed by X-ray photoelectron spectroscopy (XPS). It was found that type 2 No. 2 had less Fe the basis metal, than that in type 3 No. 2 indicating much better film. Moreover, Si content was higher in type 2 No. 2, based on the silicate content, than in type 3 No. 2. They are speculated to be the reason or the formation of a better film. Type 1 No. 2, which is mainly composed of phosphate, would be inappropriate as a metal artifact conservation treatment. It was determined that type 2 No. 2 and type 3 No. 2 water treatments, which are mainly composed of silicate, provided excellent corrosion inhibiting effects. Corrosion inhibitors could be used as emergency treatment agents during the excavation of iron artifacts.
1. 서 론
발굴현장에서 출토된 금속유물 중 철제유물이 차지하 는 비율은 높은 편이다. 철제는 그 특성으로 인해 출토되는 순간부터 급격한 환경변화로 부식의 진행이 빨라지므로 신속한 보존처리가 필요하다. 출토된 철제유물은 Figure 1 과 같이 일반적인 철제유물의 보존처리 과정을 거친 후 전 시 및 보존관리를 한다. 보존처리 과정 중 안정화처리는 유물 내부에 존재하는 부식인자를 추출하는 중요한 과정이다. 보존처리현장에서는 대부분 0.1 M Sodium sesquicarbonate (Na2CO3 + NaHCO3) 알칼리 약품이 용해된 정제수에 침 적하여 부식인자를 용출하는 방식을 사용하고 있다. 그러 나 보존처리가 완료된 유물에서도 weeping과 β-FeOOH 형성을 통해 재부식이 확인됨에 따라(McNeil and Selwyn, 2001) 부식인자를 완전히 추출했다 할 수 없으며, 주조품 의 경우 수용액에 침적할 경우 파손될 위험성이 있어 그마 저도 적용하지 못하는 단점이 있다. 따라서 부식인자의 활 동성을 차단하고 보호피막을 형성하며 기존의 용출방식을 보완하기 위한 부식억제제의 사용은 필요하다.
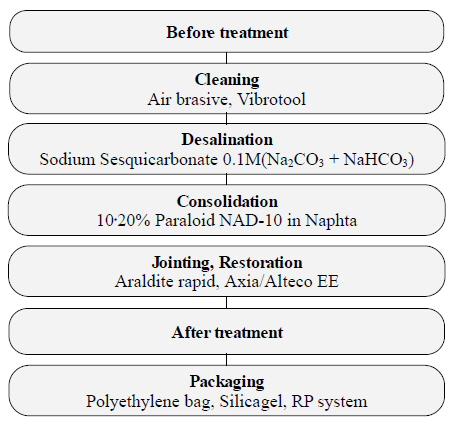
Process of iron artifacts conservation treatments(Jeong et al., 2013).
동합금유물의 부식억제제로는 B.T.A(1,2,3-Benzotriazol) 가 현장에서 대표적으로 쓰이는 약품이며 철제유물의 부 식억제제로는 기화성억제제인 D.A.N(Dicyclohexyl Ammonium Nittite)을 Ethyl alcohol 3% 농도로 용해하여 감압함침 후 사용하였으나 1980년대 후반부터는 이마저도 사용하지 않 고 있어 철제유물의 대표적인 부식억제제는 없는 실정이다 (National Research Institute of Cultural Heritage, 2009).
이 연구에서는 부식된 철제유물의 안정성을 확보하고 자 수처리제를 사용한 부식억제를 연구하였다. 수처리제 를 이용한 부식억제제의 연구는 각 5 wt%의 규산나트륨과 제이인산나트륨을 수용액에 희석하여 부식억제 효율을 비 교실험한 연구(Kim, 2012)가 있으나 산업현장에서 다양하 게 사용되는 재료에 비해 문화재에 적용한 사례는 없으며 그 효과도 정확히 밝혀진 바가 없다.
연구 대상인 수처리제는 인산염과 규산염을 주성분으로 하며, 일반적으로 수도관의 부식억제제로 사용하는 3종의 약품이다. 수처리제는 특히 탄소강관에서 부식제어 효과가 뛰어나며(National Institute of Environmental Research, 2009) 재료의 구입과 경제성, 안전성 등이 우수하여 여러 분야에 활용되고 있다. 현재 환경부에 등록된 수처리제 제 조업체는 총 25개소로 그 중 3개의 업체를 지정하여 제품화 된 액상타입의 부식억제제를 사용하였다.
실험은 강제 부식된 철제시편을 대상으로 부식억제제 에 침적하여 방식피막을 형성시킨 후, 재부식 환경을 조성 하여 부식정도를 측정하였다. 부식억제제의 안정성을 평 가하고자 정밀관찰, 시편의 중량변화율, 용출수용액의 음 이온분석, 부식억제제로 인해 생성된 피막을 분석하였다. 따라서 철제유물 부식생성물의 안정성 확보를 위해 적용 가능한 부식억제제에 대한 연구이며, 수처리제를 활용한 철제유물의 보존에 적용될 수 있기를 기대한다.
2. 이론적 배경
2.1. 부식억제제
부식억제제(Corrosion inhibitor)는 적절한 농도로 부식 시스템 내에 존재할 때, 부식성 물질의 농도를 크게 변화없 이 부식속도의 감속 역할을 하는 화학물질이라 정의한다 (KS D ISO 8044 금속의 및 합금의 부식). 본고에서 사용 한 수처리제는 수돗물에 녹물이 발생되는 것을 방지할 목 적으로 수도관의 부식을 억제하기 위하여 첨가하는 물질 을 말한다. 과거에는 방청제(Rust inhibitor)란 용어로 쓰이 다가 2007년 6월 4일 이후부터 부식억제제(Corrosion inhibitor)로 명칭을 개정하여 사용하고 있다. 이하에서는 본 연구에서 선정된 부식억제제의 종류와 특성, 메커니즘 에 대하여 조사하였다.
2.2. 수처리 부식억제제의 종류
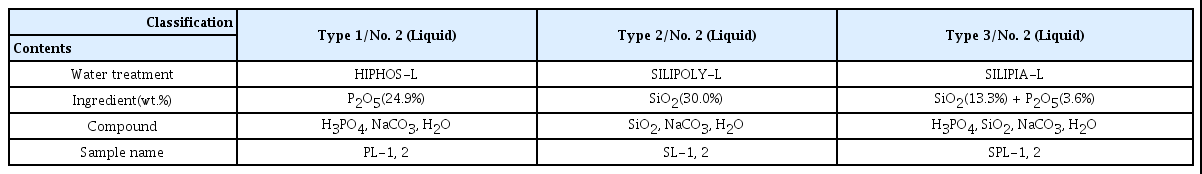
수처리제의 기준과 규격 및 표시기준(환경부고시 제 2013-188호)에 의하면 부식억제제의 종류, 사용기준, 품질 기준 등을 정하고 있다. 부식억제제의 종류는 제품의 주성 분과 제품 상태에 따라 총 6가지로 구분되며, 각 종류별 유 효성분과 성상, 함량은 Table 1과 같다. 성분에 따라 인산 염계(1종), 규산염계(2종), 인산염과 규산염의 혼합염계(3 종)으로 분류되며 제품 성상에 따라 상온에서 고상(1호) 및 액상(2호)으로 분류된다.
2.3. 양극억제제(Anode inhibitor)
부식의 속도를 억제하는 방법에는 양극반응(Anode reaction), 음극반응(Cathode reaction), 양쪽의 속도를 감소시키는 방법이 있다. 양극반응의 속도를 제어하는 방법은 부동태 화를 촉진시키는 일이며 양극 활성을 억제시키므로 양극 억제제(Anode inhibitor)라고도 한다. 양극억제제의 종류 는 정인산염, 규산염, 아질산염, 크롬산염 등이 있으며, 수 처리제에 사용되는 양극억제제의 종류에는 인산염과 규산 염, 혼합염계가 있다(Table 2). 일반적으로 쓰이는 부식억 제제가 대부분은 양극억제제일 정도로 매우 효과적이고 널리 사용되고 있다(Kim, 2012). 하지만 철제에 적용 시 양극억제제의 농도가 불충분하면 공식(Pitting)을 일으키 는 결과를 초래할 수 있으며(Lee, 2009) 표면의 색상도 변 화시킬 수 있다고 보고되고 있다. 혼합억제제(Mixed inhibitor)는 2종의 억제제를 혼합하여 방식효과를 높이고 공식을 방지할 수 있어 최근 연구개발이 활발히 진행 중이다.
2.3.1. 인산염계 부식억제제(Orthophosphates)
인산염계 부식억제제는 NaH4PO4, Na2HPO4, H3PO4, Na3PO4 등이 있으며 금속표면 위에 철, 칼슘, 아연, 염과 반 응하여 침전물을 형성시킨다. 또한 Fe²⁺와 같은 용해된 금 속이온과 불용성의 염을 생성하여 양극부위에 피막을 형 성한다. 정인산염(Orthophosphate)은 아래의 식과 같이 금 속의 용해도는 감소하게 된다. Fe(PO4)2은 다른 양극 부식 방지제에 비하여 부착력이 강하고, pH에 영향을 받지 않는 피막을 형성한다(Lim, 2010). 인산염계 부식억제제는 아 연, 구리, 알루미늄보다 철에서 더욱 효과적이다.
2.3.2. 규산염계 부식억제제(Silicates)
규산염계 부식억제제는 Na2SiO3, Na2SiO3O7 등이 있으 며, 금속의 양극부위에서 용해된 금속염과 결합한다. 이때 생성된 금속염과 규산염의 결합체는 양극부위에 Gel 상의 석축물 층을 형성하며 이 층은 다른 부식방지 피막에 비해 화학적으로 안정하다. 또한 계면활성 기능이 있으므로 tubercle 내부로 확산되어 부식을 방지하는 기능이 있다(Kim, 2003). 틈부식의 부식성과 부식경향은 온도, 응력(stress), 염화이 온의 농도가 증가할수록 커지는데 규산염계 부식억제제는 성분 중의 알칼리도로 인해 틈부식을 억제하는데 있어 인 산염계보다 효과적인 것으로 알려져 있다.
3. 연구방법
3.1. 실험약품
먹는물 관리법 제21조 제2항의 규정에 의하여 수처리제 제조업의 등록을 받은 업체는 총 25개소이다. 업체별 제조 품목이 다르므로 3개의 업체를 선정하여 각각의 종류마다 부식억제 효과 실험을 진행하였다. 실험에 사용된 부식억 제제는 각 종류별 액상타입(2호)으로 정하였으며 상온에서 무색이다. 부식억제제 1종 2호는 동해식품화학에서 제조한 HIPHOS-L, 2종 2호는 한국에스캄에서 제조한 SILIPOLY-L, 3종 2호는 삼건화학에서 제조한 SILIPIA-L을 사용하였다. 종류별 성분 및 함량은 Table 3에 나타내었다.
3.2. 실험방법
3.2.1. 시편제작
실험에 사용한 시편은 포스코에서 제조한 열간압연강 판(KSD3501 SPHC)을 사용하였으며, 규격은 30×60×1.6 mm로 제작하였다. 표면조건을 동일하게 하기 위해 모든 시편은 #400~#1200의 Sand paper로 연마하고 Polishing 하였다. 또한 불순물 및 유분을 제거하기 위하여 Ethyl alcohol과 Acetone으로 세척한 후 열풍건조기에 강제건조 하였다. Table 3에 정리했듯이 시편의 기호는 3종류의 부 식억제제의 주성분인 인산염(Phosphate), 규산염(Silicate), 혼합염의 영문 앞글자와 2호 액상타입(Liquid phase)의 영 문 앞글자로 표기하였다(Figure 2).
3.2.2. 실험방법
출토된 철제유물과 유사한 환경을 조성하고자 Polypropylene 상자에 발굴현장에서 채집한 토양을 채운 후, 금속유물의 부식에 가장 큰 영향을 미치는 NaCl 용액을 10 wt%로 제 조(KS D ISO 11130)하여 토양환경에 500 ml 주입하였다. 24시간이 지난 후, 동일한 크기로 제작한 시편을 일정하게 매장하였다. NaCl 10 wt% 용액을 동일하게 2차 주입한 후, 항온항습실(20±2℃, 45±5%)에서 3개월에 걸쳐 부식 시켰다(Figure 2). 부식된 철제시편은 초순수용액으로 세 척하고 강제건조하였다. 이후 선정한 부식억제 약품에 2시 간 감압함침하고 대기 중에 2시간 침적하여 부식억제제의 피막이 형성되도록 하였다. 부식억제제의 영향을 알아보 기 위해 방식피막이 형성된 시편을 분리된 공간에서 동일 한 조건으로 재부식 시켰다. 재부식 환경은 NaCl 10 wt% 용액에 1시간 침적한 후 일정한 온・습도가 유지되는 항온 수조에 24시간 노출하였다. 총 5차에 걸쳐 재부식을 진행 하였으며 정밀촬영, 중량변화를 반복 측정하였다. 정밀촬 영은 디지털카메라(Digital camera, D300, Nikon, Japan) 를 이용하여 1회 재부식 실험 종료 시마다 촬영하였으며, 중량변화 측정은 부식정도를 측정하는 대표적인 방법으로 전자저울(Electronic scale, TP-2000, OHAUS, USA)을 이 용하여 재부식 전 ․ 후의 중량을 측정하였다.
3.2.3. 분석방법
IC(Ion Chromatography)분석은 철제유물의 탈염액 (Sodium sesquicarbonate 용액)을 분석하여 이온성 부식 물을 확인하고 정량함으로서 탈염처리의 종료시점을 확인 하는데 사용한다. 이 연구에서는 부식된 철제시편에서 용 출된 음이온과 부식억제제를 적용하여 강제부식 후 용출 되는 음이온 수치를 비교하여 부식억제 효율을 살펴보았 다. IC기기는 DIONEX. Inc.에서 제작한 ICS-1100 model 이다. 분석컬럼은 Ionpac AS14 교환컬럼으로 Cl-, SO42-, NO3-, PO43- 음이온분석이 가능하다. 각 이온은 표준 물질 과 용리 시간 비교에 의해 정성분석이 이루어지며, 피크의 높이 또는 면적에 의해 정량분석이 계산된다.
XPS(X-ray photoelectron spectroscopy)분석은 표면의 화학적 조성과 결합 특성 변화에 따른 특정 원소의 Binding energy(eV) 변화를 알아보기 위해 실시하였다. XPS기기는 ULVAC-PHI. Inc.에서 제작한 것으로 Quantera SXM model 이다. X-ray는 Al Kα (hv = 1486.6 eV)파장을 이용하였으 며 pass energy는 13.00 eV, Beam Power는 24.6 W, Tilt Angle는 45.0°이다. survey(wide) scan으로 철제시편에 존 재하는 모든 원소를 1차적으로 분석한 다음, 약 10 nm이내 의 표면에 대한 선택적인 분석을 진행하였다. XPS 분석 실 험을 위해 부식억제제를 도포한 직후의 시편과 5회차의 강 제부식한 시편을 10×10×1.6 mm 크기로 절단하였다(Figure 3).
4. 연구결과
4.1. 표면관찰
부식억제제의 효과를 확인하기 위해 각 시편마다 1회~5 회차 재부식을 진행하였다. 회차별로 부식시킨 철제시편 의 표면상태변화는 다음과 같다(Figure 4). 대조군(ST)과 비교하였을 때, 수처리제를 적용하지 않은 대조군(ST)은 재부식 회차별로 부식생성물의 증가가 확인되며, 황색 (yellow), 적갈색(red-brown), 흑적색(black-red)의 부식생 성물이 확인된다.
부식억제제를 적용한 시편에서는 전반적으로 재부식 정도가 낮은 것으로 확인된다. 특히 SL, PSL의 경우 육안 관찰 과정에서 표면색상의 변화가 거의 확인되지 않는다. 그러나 인산염이 주성분인 PL은 부식억제제에 침적한 후 부터 시편의 표면이 노출되면서 철편 본래의 색이 확인되 었다. 이는 철제유물의 보존처리과정에서 표면 색상변화 가 없어야 하는 점에 부합하지 않는 것으로 판단된다.
4.2. 중량변화
방식피막을 형성한 철제시편을 NaCl 10 wt% 용액에 5 회차 강제 부식시킨 후 중량변화율을 살펴보았다. 0.01 g 까지 표시하였으며 Table 4에 측정결과를 나타내었다. 모 든 시편의 중량은 감소하였으나, 대조군에 비해 피막처리 를 한 시편의 중량감소율이 낮다는 것을 알 수 있다. 3종의 부식억제제를 비교한 결과 SL과 PSL의 평균 감소율은 0.03%, 0.07%로 변화율이 낮다는 것을 알 수 있다. 그에 비해 PL의 평균 감소율은 0.58%로 높게 측정되었다. 이는 재부식 후 부식생성물로 인한 중량감소가 상대적으로 많 다는 것을 알 수 있다.
4.3. IC 분석
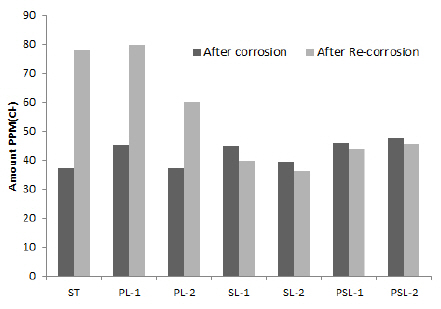
철제유물의 부식을 일으키는 부식인자인 Cl- 이온을 비 롯한 SO42-, NO3-, PO43- 음이온의 측정을 동시에 진행하였다. 철제유물의 탈염 방법 중 하나인 Sodium sesquicarbonate 법을 적용하였다. 0.1 M Sodium sesquicarbonate(Na2CO3 + NaHCO3) 알칼리 약품이 용해된 정제수에 침적시켜 60℃ 항온수조에서 온도를 지속적으로 유지하였다. 1회차 추출 된 용액으로 분석하였으며, 결과는 Table 5와 같다. Cl- 이 온과 SO42- 이온의 변화가 재부식 후 크다는 것을 알 수 있다. Cl- 이온은 37.12~47.39 ppm 범위에서 36.23~79.78 ppm 범위로 증감하였다. SO42- 이온은 6.73~8.44 ppm 범위에 서 3.70~9.03 ppm으로 증감하였으며, 대조군(ST)을 제외 한 모든 시편에서 그 수치가 감소하였다. Cl- 이온을 측정 한 결과 ST는 40.82 ppm, PL은 평균증가량이 28.60 ppm 으로 증가하였다. 상대적으로 SL은 평균감소량이 –4.08 ppm, PSL은 –1.94 ppm으로 감소하였다. Cl- 이온의 용출 양이 적은 순서는 SL, PSL, PL 순으로 규산염(2종2호)과 복합염(3종2호)에 침적시킨 시편에 부식억제 효율이 높게 나타났다(Figure 5).
4.4. XPS 분석
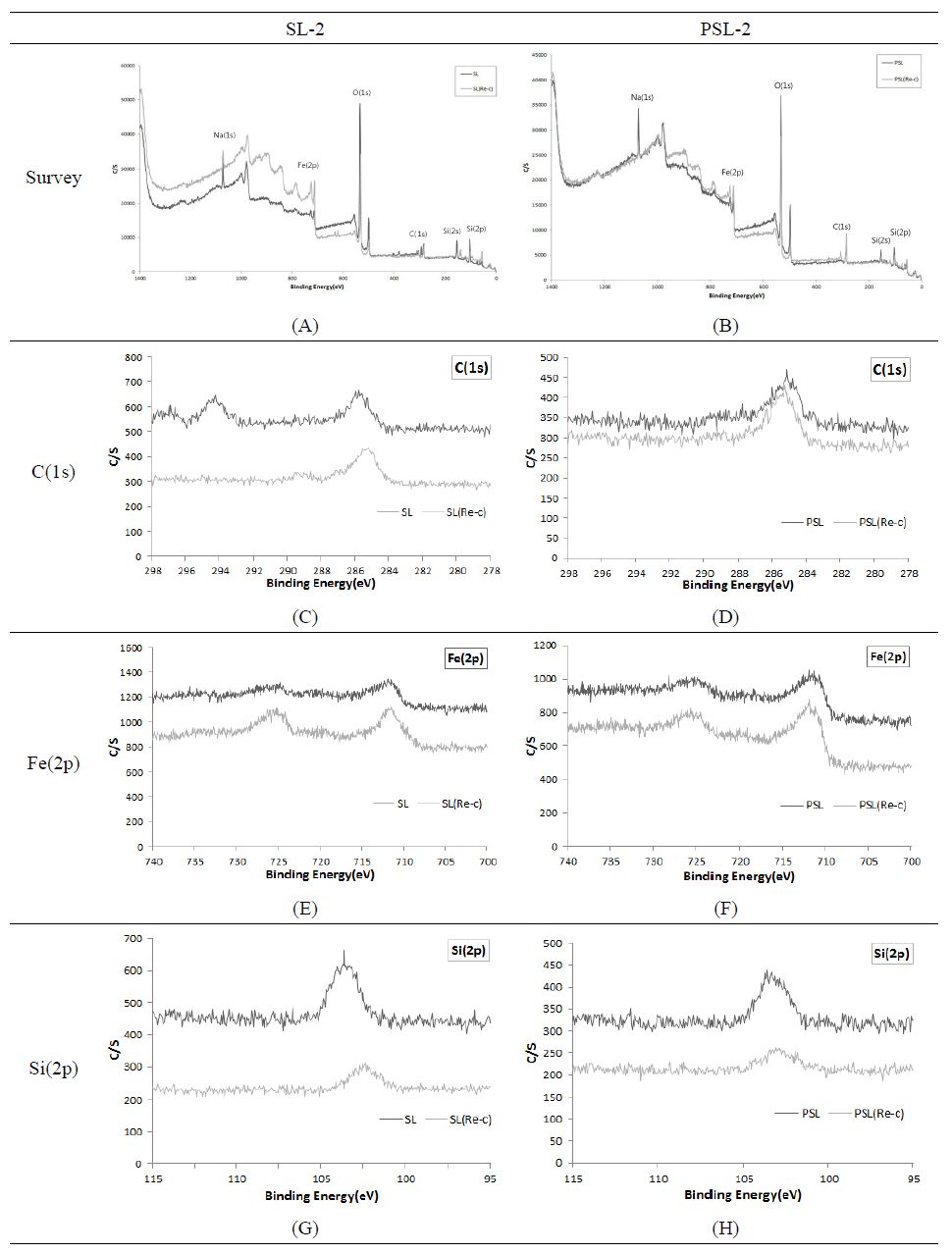
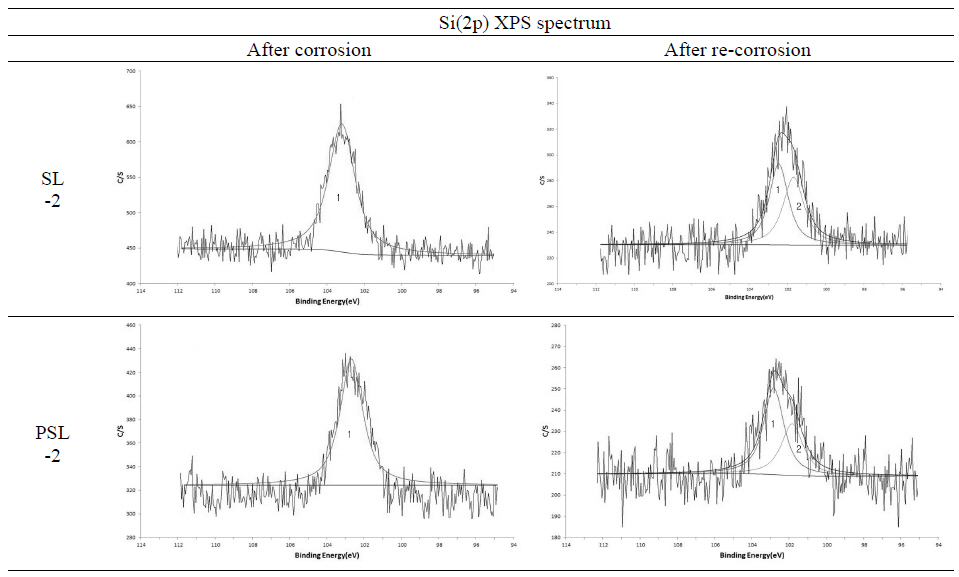
표면처리 후 시편 원래의 색이 변화되어 부적격 재료로 판단되는 PL시편을 제외한 SL-2과 PSL-2의 시편을 대상 으로 XPS분석을 진행하였다. 우선, 표면에 존재하는 모든 원소를 확인하기 위해 survey scan을 실시하였으며, 특정 원소의 결합 특성변화를 알아보기 위해 narrow scan을 하 였다. Figure 6은 SL-2, PSL-2 시편의 표면을 분석한 결과 이다. Figure 6A, 6B는 survey scan에서 energy range를 0~1200 eV로 해서 표면에 존재하는 모든 원소를 1차적으 로 조사한 것이다. C(1s), O(1s), Fe(2p), Si(2p), Na(1s)등 의 peak가 공통으로 검출되었다. 부식억제제 침적 직후에 는 PSL-2 시편의 표면에서 P(2p) 원소가 확인되었으나 재 부식 이후에는 검출량이 미미하여 확인이 불가능한 것을 알 수 있다. 검출된 원소의 결합에너지 peak 위치는 C(1s) 285 eV, O(1s) 530 eV, Fe(2p) 707~720 eV, Si(2p) 99 eV, P(2p) 130 eV, Na(1s) 1073 eV 이다. Figure 6C, 6D는 Carbon(1s) peak를 narrow scan한 결과이다. SL-2, PSL-2 의 시편 모두 285 eV에 peak가 검출되는 것으로 보아 표면 의 탄소 상태는 재부식 전과 후에 큰 차이가 없어 보인다. Figure 6E, 6F는 Iron Fe(2p) peak를 narrow scan한 결과 이며 피막의 두께에 따라 검출되는 Fe(2p)양을 상대적으로 알 수 있다. 재부식 후의 시편이 부식억제제에 침적한 직후 의 시편보다 Fe(2p)의 양이 많게 검출되었다. 이것은 5회 차 부식 후 피막의 두께가 얇아져 소지금속인 Fe가 높게 검 출되었다는 것을 알 수 있다. 하지만 재부식 후 SL-2 시편 보다 PSL-2 시편의 변화량이 높은 것으로 볼 때 SL-2 시편 의 피막형성이 상대적으로 잘 유지하고 있음을 알 수 있다. Figure 6G, 6H는 Silicon Si(2p) peak를 narrow scan한 결 과이며 두 시편 모두 재부식 전과 후를 비교하였을 때 Binding energy가 낮은 쪽으로 이동하였다는 것을 알 수 있다. 또한 재부식 후 Si의 함량은 낮아졌으나 재부식 전과 비례하여 검출되었다는 것을 알 수 있다. High resolution XPS spectrum에 있어서 curve fitting 분리작업을 통해 Si(2p) spectrum의 화학적 결합상태를 확인할 수 있었다 (Figure 7). 재부식 후의 SL-2, PSL-2의 시편에서 표면 화 합물의 상태가 다른 SiO2(103 eV), Si2O3(102 eV) 2가지 결합에너지가 확인되었다. Si(2p)의 중심에 위치해있는 SiO2(103 eV) 화합물을 1 peak, Si2O3(102 eV) 을 2 peak 로 표시하였다. 두 시료 모두 재부식전에는 표면화합물 상 태가 SiO2로 검출되나, 5차에 걸친 강제부식 후에는 SiO2 와 Si2O3의 화합물이 확인된다. 이것은 부식작용으로 인해 산소와 결합하여 에너지가 낮은 상태로 변형하는 단계로 보여진다. 재부식 후 Si의 함량을 비교하였을 때 PSL-2 시 편보다 SL-2의 시편에서 높게 검출되는 것을 알 수 있다. 이것은 PSL-2의 시편에 미량 함유된 P2O5의 첨가 유무에 는 영향을 받지 않고 규산염의 함유량에 따른 상대적 결과 로 확인된다.
5. 결 론
출토된 철제유물의 보존처리 과정에서 부식인자의 추 출 및 제어는 중요한 부분이다. 일반적으로 유물의 상태에 따라 탈염조건을 달리하여 내부의 음이온을 용출하여 부 식인자를 제거한다. 하지만 부식인자의 완벽한 제거여부 를 확인할 수 없으며, 주조 또는 부식이 심한 유물의 경우 는 적용할 수 없다. 따라서 기존의 용출처리를 보완할 부식 억제제의 사용이 적극 검토되어야 한다. 이 연구에서는 출 토 철제유물의 부식억제를 위해 일반적으로 수도관 부식 억제제로 사용되는 수처리제를 연구하였으며, 수처리제 3 종에 대한 실험결과는 다음과 같이 정리할 수 있다.
첫 번째, 표면관찰 결과 2종 2호, 3종 2호의 부식억제제 에 침적한 철제시편의 색상 변화는 거의 없다. 그러나 인산 염이 주성분인 1종 2호의 부식억제제는 시편에 발생한 표 면의 녹을 제거하였다. 이는 철제유물에서 소지금속을 보 호하는 녹층을 제거하는 결과로서 1종 2호의 부식억제제 는 금속유물 보존처리에 부적합한 것으로 판단된다.
두 번째, 재부식 시편 각각의 중량 감소율 평균은 1종 2 호의 경우 0.58%, 2종 2호의 경우 0.03%, 3종 2호의 경우 0.07%이며, 규산염을 주성분으로 하는 부식억제제에 중량 감소율이 낮았으며, 상대적으로 중량 감소율이 높았던 1종 2호는 부식억제 효과가 낮다고 판단된다.
세 번째, 부식을 일으키는 주된 인자인 Cl-이온의 변화 량을 분석하기 위하여 IC로 분석한 결과, 용액에 용출된 Cl-이온의 증가량 평균은 1종 2호는 28.60 ppm, 2종 2호는 –4.08 ppm, 3종 2호는 –1.94 ppm이었다. Cl-이온의 용출 량이 상대적으로 높은 1종 2호(인산염)은 부식억제 효과가 낮고, Cl-이온이 감소된 2종 2호(규산염)와 3종 2호(혼합 염)의 부식억제 효율이 높은 것으로 판단된다.
네 번째, 부식억제제에 침적한 후 색상변화가 진행된 1 종 2호를 제외한 2종 2호, 3종 2호를 대상으로 XPS 분석한 결과, 수처리제 피막이 형성된 후 재부식된 2개의 시편 중 3종 2호보다 2종 2호에서 Fe의 함량이 낮게 검출되어 다소 우수한 피막을 유지하였고, Si 함량에서도 규산염 기반의 2종 2호에서 상대적으로 함량이 높아 수처리제의 흡착피 막형성이 높은 것으로 판단된다. 또한 Si(2p) spectrum에 서 강제부식으로 인해 산소와 결합하여 Binding energy가 낮은 쪽은 이동하였다는 것을 확인할 수 있었다.
다섯 번째, 실험결과를 종합하면 인산염을 주성분으로 한 1종 2호의 수처리제(HIPHOS-L)는 철제 표면의 녹층을 연질화하여 철심이 노출됨으로 보존처리약품으로 부적합하 고, 규산염을 주성분을 한 2종 2호와 3종 2호의 수처리제 (SILIPOLY-L, SILIPIA-L)는 부식억제 효과가 우수하다. 또한 이번 실험에서는 인산염(P2O5)의 첨가에 관계없이 규 산염의 농도가 높을수록 피막형성이 우수하다고 평가된다.
이번 연구에 사용한 수처리제는 수도관의 부식억제 뿐 만 아니라 생활 속 다양한 분야에 활용되는 재료로 무색, 무취, 경제성, 안전성이 입증된 약품이다. 이 연구는 일정 한 환경에 부식시킨 시편을 3종류의 수처리제를 적용하여 제한된 조건에서 실험한 결과이므로 보존처리현장에 적용 하기 위해서는 침적시간 및 횟수, 농도, 건조시간 등 다양 한 조건의 실험을 필요로 한다. 앞으로 추가적인 연구를 진 행하고자 하며, 철제유물의 재부식 방지를 위한 부식억제 제는 보존처리과정 뿐만 아니라 철제유물의 출토에 있어 서 긴급하게 사용할 수 있는 약품으로도 활용될 수 있을 것이다.