저습지 출토 수침고목재의 미생물 분해 특징 및 미생물 군집 분석
Characterization of Microbial Decay and Microbial Communities in Waterlogged Archaeological Wood Excavated from the Wetland
Article information
Abstract
본 연구에서는 광주광역시 동림동 유적의 저습지에서 출토된 3점의 활엽수 수침고목재(동림 1, 동림 2, 동림 3)를 대상으로 미생물 분해에 따른 해부학적, 화학적 특성 변화를 파악하고 수침고목재에 존재하는 미생물 군집을 조사하였다. 동림 1−3의 최대함수율은 건전재의 최대함수율보다 6∼8배 정도 높았으며 매장 기간과의 상관관계는 나타나지 않았다. 화학분석 결과 동림 1−3의 회분 및 온수추출물 함량은 건전재에 비해 증가한 반면 유기용매 추출물 함량은 감소하는 경향을 나타내었다. 아울러 홀로셀룰로오스 함량은 크게 감소하고 리그닌 함량은 상대적으로 크게 증가하였다. 현미경 관찰 결과 동림 1−3 모두에서 침식형 세균과 연부후균에 의한 피해가 관찰되었다. 차세대염기서열분석 기법을 통해 동림 2와 3의 미생물 군집을 분석한 결과 두 시료 모두에서 자낭균문(98∼99%)이 진균 군집(fungal community)의 대부분을 차지하였고, 세균 군집(bacterial community)에서는 Proteobacteria문(34∼55%)이 가장 우세한 군집으로 검출되었다. 그러나 전체적인 미생물 군집 구조와 다양성은 동림 2와 3 사이에 현저한 차이를 보였다.
Trans Abstract
Anatomical and chemical changes due to microbial decay and microbial communities in three waterlogged archaeological woods, namely Dongnim 1, Dongnim 2, and Dongnim 3, excavated from the wetland of the Dongnim-dong archaeological site in Gwangju, were investigated. Dongnim 1−3 exhibited a maximum moisture content approximately 6 to 8 times higher than that of undecayed recent wood, and there was no correlation with the burial period. Chemical analysis revealed an increase in ash and hot water extractive content in Dongnim 1−3 compared to undecayed recent wood, while the solvent extractive content tended to decrease. Additionally, there was a significant decrease in holocellulose content with a relative increase in lignin concentration in Dongnim 1−3. Microscopic observations showed erosion bacteria decay and soft rot decay in Dongnim 1−3. The microbial community analysis of Dongnim 2 and 3 revealed the dominance of Ascomycota (98% to 99%) in the fungal community and Proteobacteria (34% to 55%) as the predominant bacterial phylum. Nonetheless, significant differences in microbial community structure and diversity were observed between Dongnim 2 and Dongnim 3.
1. 서 론
목재는 크게 생물학적(biotic)인 요인과 비생물학적(abiotic)인 요인에 의해 열화된다. 생물학적인 요인은 목재가 위치한 환경에 따라 진균(fungi), 세균(bacteria), 곤충, 해양천공동물(marine borer) 등이 관여하고, 비생물학적 요인으로는 열, 자외선, 온습도, 비, 바람 등이 복합적으로 작용한다. 그러나 목재가 땅속이나 물속과 같이 극한의 환경에 놓이게 되면 열화에 관여하는 요인이 현저하게 줄어들고 일부 생물학적 요인들에 의해서만 열화가 진행된다(Broda and Hill, 2021). 즉, 저습지나 해양 등에서 오랜 기간 매장되었다가 발굴된 수침고목재(waterlogged archaeological wood)는 주로 생물학적 요인에 의해 열화된다고 할 수 있다.
전술한 바와 같이 수침고목재의 생물학적 열화 요인은 크게 미생물(진균, 세균)과 해양천공동물로 구분할 수 있다. 해양천공동물에 의한 침해는 해양환경에서만 가능하지만, 미생물에 의한 분해는 해양이나 육지의 다양한 환경에서 발굴된 수침고목재에서 광범위하게 관찰된다. 일반적으로 수침고목재의 미생물 분해에는 갈색부후(brown rot)나 백색부후(white rot)를 유발하는 담자균(Basidiomycota)은 관여하지 않으며, 주로 혐기성이나 준혐기성 조건에서도 생장이 가능한 세균(bacteria)에 의해 발생한다(Blanchette et al., 1990; Kim and Singh, 2000; Singh et al., 2016). 자낭균(Ascomycota)과 불완전균(Fungi imperfecti)에 의한 연부 후(soft rot decay) 피해 또한 수침고목재에서 빈번히 관찰된다(Björdal, 2012; Björdal and Dayton, 2020; Blanchette, 2000; Kim and Singh, 2000; Singh et al., 2016, 2019). 세균이나 연부후균은 갈색부후균이나 백색부후균과 비교하여 목재의 분해속도가 훨씬 느리다(Kim and Singh, 2000). 따라서 미생물에 의한 수침고목재의 분해는 육지 환경에 노출된 목재와 비교하여 상대적으로 매우 완만하게 진행된다. 그러나 세균이나 연부후균의 공격이 장기간 지속되면 수침고목재 또한 광범위하게 분해될 수 있다. 일반적으로 수침고목재의 미생물 분해 정도는 매장 기간에 반드시 비례하지 않는 경우가 많으며 매장지의 환경 조건과 목재 수종 및 부위 등 여러 요소들에 의해 크게 달라진다(Björdal, 2012; Björdal et al., 1999). 따라서 동일한 기준으로 모든 수침고목재의 미생물 분해 유형 및 상태를 평가하는 것은 적절하지 않다.
수침고목재를 분해하는 세균은 목재세포벽을 분해하는 양태에 따라 크게 침식형 세균(erosion bacteria)과 동굴형 세균(tunneling bacteria)으로 구분된다(Kim and Singh, 2000; Singh et al., 2022). 침식형 세균은 혐기성 조건하에서 셀룰로오스나 헤미셀룰로오스와 같은 다당류를 주로 선택적으로 분해할 뿐 리그닌은 거의 분해하지 않는 것으로 알려져 있다(Kim and Singh, 2000; Singh et al., 2022). 따라서 침식형 세균 피해를 받은 수침고목재의 2차벽에서는 분해되지 않은 리그닌이나 리그닌 유래 물질들이 관찰되며, 분해가 심할 경우 세포의 형태가 왜곡되거나 세포벽이 팽윤되어 나타난다(Cha et al., 2021; Singh et al., 2022). 반면에 리그닌 농도가 높은 중간층(middle lamella)은 거의 분해되지 않고 남게 된다(Singh et al., 2022). 이 같은 분해양태는 수침고목재의 최대함수율(maximum moisture content) 증가와 밀접히 관련되어 있다. 국내에서는 서해안의 대부도 앞바다에서 발굴된 대부도 2호선의 선체 목부재에서 침식형 세균에 의한 피해가 관찰되었다(Cha et al., 2021). 침식형 세균과 대조적으로 동굴형 세균은 어느 정도 산소가 존재하는 환경에서 다당류와 함께 리그닌 또한 분해할 수 있는 것으로 알려져 있다(Singh et al., 2022). 따라서 동굴형 세균은 수침고목재의 2차벽 뿐만 아니라 중간층도 분해할 수 있다(Singh et al., 2022). 동굴형 세균과 유사하게 어느 정도 공기와 접촉하고 있는 수침고목재에서는 연부후 피해가 빈번히 관찰된다(Kim and Singh, 2000; Singh et al., 2022). 연부후균은 주로 목재의 다당류를 분해하고 리그닌도 부분적으로 분해할 수 있는 능력을 가지고 있지만 그 분해능은 갈색부후균이나 백색부후균에 비해 떨어진다. 국내에서는 신안선 선체의 마미송(Pinus massoniana)과 신안선에 실려 있던 자단목(Dalbergia spp.) 등에서 연부후 피해가 관찰되었다(Kim, 1989; Kim et al., 2023).
전술한 수침고목재의 해부학적, 화학적 특성 연구와 더불어 최근에는 급속도로 발전하는 분자생물학적 기법을 기반으로 수침고목재 내에 존재하는 미생물 군집(microbial community)에 대한 연구가 활발히 수행되고 있다(Antonelli et al., 2020; Landy et al., 2008; Li et al., 2018; Liu et al., 2018; Preston et al., 2012). 기존의 배양을 통한 미생물 군집에 대한 연구는 수침고목재 내 서식하는 전체 미생물의 극히 일부만을 재현할 수 있으며, 현미경 동정을 통한 형태적 분류 또한 어려움이 있어 전체 미생물 군집을 이해하는데 한계가 있었다. 그러나 대용량 자동화 염기서열 분석을 기반으로 하는 차세대염기서열분석(next-generation sequencing, NGS) 기법은 많은 양의 염기서열을 컴퓨터 프로그램을 기반으로 단시간에 분석할 수 있는 방법으로 다양한 연구 분야에 활용되고 있다(Vincent et al., 2017). NGS 기반의 내부 전사 스페이서(internal transcribed spacer) 및 16S 리보솜 RNA (ribosomal RNA) 유전자의 염기 서열 분석은 수침고목재 내의 복잡한 미생물 군집에서 진균과 세균의 동정을 가능케 한다. 그러나 아직까지 우리나라의 해양이나 저습지 등에서 수침고목재의 분해에 관련하는 미생물 군집 구조나 다양성 등은 거의 알려져 있지 않다. 향후 해양과 저습지 유적 등에서 발굴된 수침고목재의 미생물 군집 연구 자료 및 각 미생물의 열화 특성이 축척된다면, 각각의 수침고목재가 출토된 매장환경에 대한 기초정보 뿐만 아니라 수침고 목재의 특성을 상대적으로 쉽고 정확하게 파악할 수 있을 것이다. 또한 이를 통해 보존 및 관리에 필요한 기초정보 및 고습환경이나 수중에 노출된 목재의 보존 방법을 개발하는 데에도 중요한 기초자료로 활용할 수 있을 것이다.
본 연구에서는 우리나라 저습지에서 출토된 3점의 수침고목재를 대상으로 미생물 분해 특징을 조사하였다. 최대함수율 측정을 통해 수침고목재의 분해 정도를 가늠하고 매장기간과의 연관성을 살펴보았다. 아울러 화학분석 및 현미경 관찰을 통해 저습지 수침고목재에서 나타나는 미생물 열화 유형 및 특성을 파악하고 기 보고되었던 우리나라 해양에서 출수된 고선박 수침고목재의 특징과 비교 분석하였다. 또한 차세대염기서열분석 기법을 통해 저습지 수침고목재에 존재하는 미생물 군집 구조와 다양성을 조사하였다.
2. 재료 및 방법
2.1. 공시재료
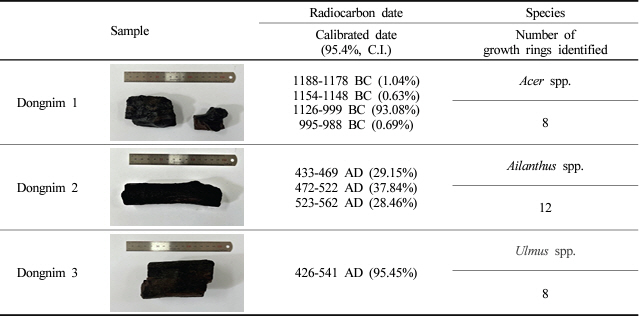
광주광역시 동림동 유적의 저습지에서 출토된 3점의 수침출토 고목재(이하, 동림 1, 동림 2, 동림 3)를 실험에 사용하였다(Honam Cultural Property Research Center, 2007). 수침고목재는 2005년 수습한 후, 물에 침지된 상태로 밀폐용기에 넣어 상온에서 보관되어왔다(Table 1). 방사성탄소연대 측정법에 따른 수침고목재의 추정 연대와 수종 식별결과는 Table 1과 같다.
2.2. 최대함수율 측정
각 수침고목재의 횡단면을 기준으로 외각(outer), 중앙(middle), 중심(inner) 부위로부터 약 1 × 1 × 1 cm3 크기의 목편을 채취하여 최대함수율을 측정하였다. 목편을 물로 포화시키기 위해 진공펌프(4.08 bar)를 이용하여 일정한 질량이 얻어질 때까지 30분 단위로 반복처리 하였다. 포수된 시료의 중량을 측정한 후, 103 ± 3℃에서 건조하여 전건중량을 측정하였다. 최대함수율은 아래 식에 따라 계산하였다.
2.3. 화학 분석
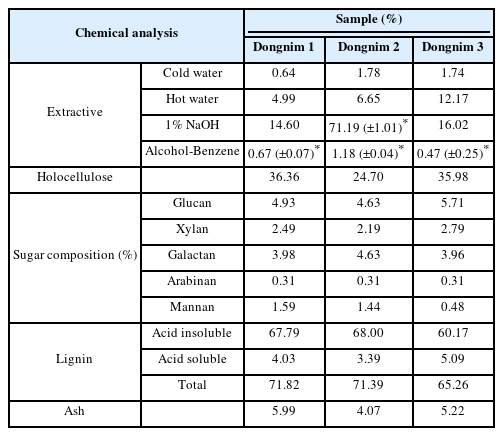
각 수침고목재를 상온에서 건조한 후, 20∼80 mesh 크기의 목분으로 분쇄하여 화학 분석을 진행하였다. TAPPI standard(TAPPI test methods, 1996)에 근거하여 회분(T211), 냉수와 온수 추출물(T207), 1% NaOH 추출물(T212), 알콜-벤젠 추출물(T204), 리그닌(T222) 함량을 정량하였다. 홀로셀룰로오스 함량은 Wise법(Wise et al., 1946)에 따라 아염소산나트륨(NaClO2)을 사용하여 정량하였다. 당(sugar) 분석은 NREL(National Renewable Energy Laboratory) 방법에 따라 수행하였다(Sluiter et al., 2008). 반복 실험에 필요한 충분한 양의 시료가 확보되지 않아 일부 분석에만 한정하여 3회 반복 실험을 수행하였다.
2.4. 현미경 관찰
각 수침고목재로부터 작은 목편을 채취하여 2%(v/v) glutaraldehyde와 2%(v/v) paraformaldehyde가 함유된 sodium cacodylate buffer(0.05 M, pH 7.2)에 침시 시킨 후 상온에서 4시간 동안 고정처리 하였다. 에탄올을 이용하여 저농도에서 고농도(50%, 70%, 80%, 90%, 95%, 100%)로 순차적으로 탈수한 후 LR-white 수지(London Resin Company Ltd., Basingstoke, UK)로 포매하였다. 다이아몬드 칼(diamond knife)이 장착된 울트라마이크로톰(ultramicrotome)을 사용하여 약 1 µm 두께의 절편을 제작한 다음 70℃ 가열판 위에서 1% toluidine blue로 염색하였다. 이후 Canada balsam(Sigma-Aldrich, USA)으로 봉입하여 광학현미경(Olympus BX53, Tokyo, Japan) 으로 관찰하였다. 이미지는 Olympus DP 73 digital camera(Tokyo, Japan) 이용하여 촬영하였다.
2.5. 미생물 군집 분석
각 수침고목재의 외각 부위로부터 작은 목편을 채취하여 액체 질소로 동결, 분쇄한 후 250 mg의 시료를 채취하여 RBB+C(Repeated Bead Beating Plus Column, Yu and Morrison, 2004)방법에 따라 Metagenomic DNA를 추출하였다. Bacterial DNA library 제작을 위해 341F(5’-CCTACGGGNGGCWGCAG)와 805R(5’-GACTACHVGGGTATCTAATCC) primer를 사용하여 16S rRNA 유전자의 V3-V4 영역을 중합효소연쇄반응(polymerase chain reaction, PCR)을 통해 증폭하였다. Fungal DNA library는 ITS7F(5’-GTGARTCATCGAATCTTTG-3’)와 ITS4R(5’-TCCTCCGCTTATTGATATGC-3’) primer를 사용하여 제작하였다. 16S rRNA 및 ITS 유전자의 amplicon sequencing은 마크로젠(서울, 한국)의 MiSeq® Illumina 시퀀싱 플랫폼(Illunima, San Diego, CA, USA)을 이용하여 수행하였다. Amplicon sequencing으로부터 획득한 paired read는 FLASH 프로그램 v1.2.11을 사용하여 병합하였다(Magoc and Salzberg, 2011). 시퀀싱 데이터 및 미생물 군집 분석은 Quantitative Insights Into Microbial Ecology(QIIME, 버전 1.9)을 사용하여 수행하였다(Caporaso et al., 2010). Operational taxonomic units은 CD-HIT-OTU 방법을 사용하여 분석하였다(Li et al., 2012). NCBI(National Center for Biotechnology Information) Reference Sequence(RefSeq) 데이터베이스(http://www.ncbi.nlm.nih.gov/RefSeq/)에서 제공하는 BLAST (버전 2.9.0+) (Zhang et al., 2000)와 UNITE 데이터베이스(버전 8.2; https://unite.ut.ee)에서 제공하는 UCLUST 방법(Edgar, 2010)을 사용하여 세균 및 진균의 taxa를 각각 분류하였다.
3. 결과 및 고찰
3.1. 최대함수율 변화
최대함수율 측정은 수침고목재의 열화 정도를 진단하는데 빈번히 사용되는 방법으로서 그 값의 범위에 따라 수침고목재의 전반적인 열화 정도를 판단할 수 있다(Cha, 2017; De Jong, 1977; McConnachie et al., 2008). 일반적으로 미생물 열화 피해를 받지 않은 건전한 활엽수재의 최대함수율은 대략 120%를 나타낸다. 각 수침고목재의 외각(outer), 중앙(middle), 중심(inner) 부위에서 측정한 최대함수율은 Table 2와 같다. 동림 1의 최대함수율은 외각에서 중심부로 향할수록 낮아졌으나, 동림 2와 3에서는 이 같은 경향이 나타나지 않았다. 세 지점의 평균 최대함수율은 동림 1−3이 각각 755%, 1,006%, 631%를 나타내어 건전한 활엽수재의 최대함수율보다 6∼8배 정도 높았다. 이 같은 최대함수율 증가는 수침고목재가 매장되어 있던 동안 미생물 분해에 의해 목재세포벽의 다공성 증가로 인하여 발생한 것으로 해석할 수 있다.
De Jong(1977)은 최대함수율에 따라 수침고목재의 열화 정도를 3단계(Class I−III)로 구분하였다. 동림 1−3의 최대함수율은 모두 400%이상으로 Class I에 해당하며, 이는 미생물 열화로 인해 수침고목재에 건전한 부분이 거의 남아있지 않는 상태를 의미한다. 특히, 동림 2는 최대함수율이 다른 두 시료에 비해 현저히 높아 열화가 가장 심하게 진행된 것으로 판단된다. 동림 1(1126−999 BC)은 매장기간이 가장 오래되었음에도 불구하고 상대적으로 매장 기간이 짧은 동림 2(433−562 AD)에 비해 낮은 최대함수율을 나타내었다(Tables 1, 2). 이 같은 결과는 수침고목재의 매장 기간과 열화 정도가 반드시 비례하지는 않는다는 것을 시사하고 있다. 일반적으로 수침고목재의 미생물 열화에는 매장 기간뿐만 아니라 목재수종 및 부위, 매장 환경 등 여러 요소가 복합적으로 작용한다(Björdal, 2012).
3.2. 화학조성 변화
동림 1−3의 화학조성 분석 결과는 Table 3과 같다. 일반적으로 목재의 화학조성은 수종에 따라 차이를 보이며 동일한 수종이라 할지라도 원산지 및 수령, 수간과 가지, 성숙목과 유령목, 수간내의 위치에 따라서 다르고, 동일한 목재 안에서도 변재와 심재 등에 따라서도 차이를 나타낸다. 본 연구에서 사용한 동림 1−3 수침고목재는 동일 속의 타 목재 수종과의 해부학적 유사성으로 인해 종(species) 수준으로 식별이 불가능하였으며, 정확한 출처(원산지, 부위, 수령 등)를 확인할 수 없었다. 따라서 본 논문에서는 기존 문헌에서 보고된 동일 속(genus) 수종들의 화학적 특징을 바탕으로 동림 1−3의 화학조성 변화를 분석하였다.
3.2.1. 회분 및 추출물 함량 변화
동림 1−3의 회분함량은 4∼6%로 건전한 동일 속(genus) 수종들의 회분함량(1% 전후, Pettersen, 1984; Rowell et al., 2012; Terzopoulou et al., 2023) 보다 높게 측정되었다(Table 3). 이 같은 회분함량의 증가는 미생물 열화에 따른 자체 부산물의 증가가 아닌 수침고목재가 매장되어 있던 주위 환경으로부터 유입된 무기물의 퇴적으로 일어나는 현상으로 널리 알려져 있다. 우리나라 해양에서 인양된 신안선, 영흥도선, 진도선, 완도선 등에서도 유사한 경향이 나타났다(Cha, 2017; Kim, 1990a, 1993; Kim, 1990b).
선행연구에 의하면 수침고목재는 건전재에 비해 알칼리추출물(1% NaOH)의 함량이 높게 측정되는 것이 일반적이다(Cha, 2017; Kim, 1990b; Liu et al., 2023; Passialis, 1997). 이는 미생물 열화에 의해 일부 다당류가 저분자화되어 알칼리 추출과정에서 용출되기 되기 때문으로 알려져 있다(Kim, 1990b). 동림 1−3의 알칼리추출물 함량은 각각 14.6%, 71.2%, 16.0%를 나타내었다(Table 3). Pettersen(1984)에 따르면 건전한 일본산 단풍나무속 4수종과 느릅나무속 2수종의 알칼리추출물 함량은 각각 4∼24%과 15∼23%로 수종 간 큰 변이를 나타내었다. 유사한 변이가 북미산 단풍나무속 5수종(10∼21%)과 느릅나무속 2수종(14∼16%)에서도 관찰되었다(Rowell, 2012). 이 같은 수종 간 차이로 인해 동림 1(단풍나무속)과 동림 3(느릅나무속)의 알칼리추출물 함량 변화는 명확히 판단할 수 없었다. 그러나 동림 2의 경우 알칼리추출물 함량이 71.2%로 매우 높은 수치를 나타내었고 기존에 보고되었던 가죽나무속의 대표적인 수종 중 하나인 가죽나무(Ailanthus altissima)의 1% NaOH 추출물 함량(약 16∼22%, Baptista et al., 2014) 보다도 3배 이상 높게 측정되었다. 이 같은 수치는 선행연구에서 보고되었던 수침고목재의 1% NaOH 추출물 함량보다도 이례적으로 높은 수치로, 현재로서는 헤미셀룰로오스와 셀룰로오스와 같은 목재를 구성하는 다당류의 대부분이 미생물에 의해 저분자화되어 추출과정에서 용출된 것으로 추정된다. 아울러 보통의 알칼리추출물 이외의 물질이 추출과정에서 함께 추출되었을 가능성도 있다. 이 같은 가능성과 연관된 것으로 보이는 현상이 동림 2의 현미경 관찰결과에서 보였다(Figure 1). 이에 대한 것은 아래의 “3.3. 미생물 분해 양태” 단락에서 논하겠다. 정도의 차이는 있지만 우리나라 해양에서 인양된 고선박 수침고목재(신안선, 완도선, 영흥도선)에서도 알칼리추출물 함량이 건전한 최근재에 비해 큰 폭으로 증가하였다(Cha, 2017; Kim, 1993; Kim, 1990b).
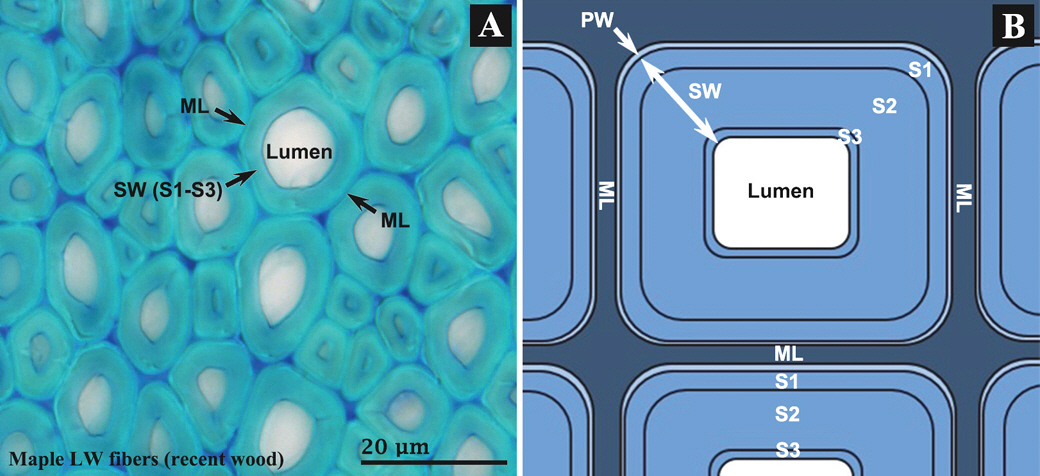
Anatomical structure of undecayed maple latewood (LW) fibers after staining with toluidine blue (A) and schematic diagram of fiber cell wall structure (B). ML, middle lamella; PW, primary cell wall; SW, secondary cell wall.
동림 1−3의 온수추출물 함량은 각각 5.0%, 6.7%, 12.2% 정도를 나타내었다(Table 3). 이러한 결과는 선행연구에서 보고된 건전한 단풍나무속(2∼7%), 가죽나무속(2∼3%), 느릅나무속(2∼4%) 수종들의 온수추출물 함량보다 전체적으로 높았다(Baptista et al., 2014; Pettersen, 1984; Rowell et al., 2012). 정도의 차이는 있지만 비슷한 경향의 증가가 신안선 선체목인 마미송(Pinus massoniana) 수침고 목재에서 관찰되었다(Kim 1990b). 이러한 온수추출물 함량의 증가는 미생물에 의해 저분자화된 일부 다당류가 온수추출과정에서 용출되었기 때문으로 판단하였다(Kim 1990b). 그러나 이 같은 선행연구와 달리 영흥도선, 진도선, 완도선 수침고목재의 온수추출물 함량은 건전한 최근재에 비해 감소하는 경향을 나타내었으며, 이는 수침고목재가 매장되어 있는 동안 수용성 물질이 수침고목재 밖으로 용출되기 때문으로 해석되었다(Cha, 2017; Kim 1990a, 1993).
동림 1−3의 유기용매추출물은 0.5∼1.2%를 나타내었다(Table 3). 이는 기존 문헌에 보고된 건전한 목재의 유기용매추출물 함량(1∼3%)에 비해 낮았다(Rowell et al., 2012; Baptista et al., 2014). 비슷한 경향의 유기용매추출물 변화가 신안선 선체목인 마미송과 영흥도선 목부재(소나무속)에서도 나타났다(Cha, 2017; Kim 1990b). 그러나 진도선과 완도선 목부재에서는 반대되는 경향을 보였다(Kim, 1990a, 1993).
종합하자면, 저습지에서 출토된 동림 1−3 수침고목재의 회분 함량 변화는 기 보고된 우리나라 해양에서 출수된 고선박 수침고목재의 결과와 동일한 경향을 나타내었다. 즉, 매장환경이나 수종과 관계없이 동일한 경향을 나타내었다. 알칼리추출물의 경우 정도의 차이는 있지만 동림 2에서 고선박 수침고목재와 유사한 경향을 보였다. 다만, 전술한 바와 같이 동림 1과 3에서의 변화는 명확히 판단할 수 없었다. 온수 및 유기용매추출물은 고선박 수침고목재 간에도 변이를 보여 저습지에서 출토된 동림 1−3과의 관련성을 파악할 수 없었다. 매장환경이나 목재수종, 수령과 부위(성숙재와 미성숙재, 심재와 변재), 미생물 분해 정도 및 관련 미생물 종 등에 따라 온수 및 유기용매추출물 함량에 변화가 발생하는 것으로 추정된다.
3.2.2. 홀로셀룰로오스 및 리그닌 함량 변화
동림 1−3의 홀로셀룰로오스 함량은 각각 36.4%, 24.7%, 36.0% 정도를 나타내었다(Table 3). 최대함수율 결과와 유사하게 미생물 열화가 가장 심한 동림 2의 함량이 다른 두 시료보다 낮게 측정되었다. 산가용성과 산불용성 리그닌을 합한 총 리그닌 함량은 동림 1−3에서 각각 71.8%, 71.4%, 65.3%로 측정되었다. 선행연구에 의하면 동일 속에 속한 수종들의 홀로셀룰로오스 및 리그닌 함량은 각각 77∼82%와 21∼27%를 나타내었다(Baptista et al., 2014; Bardak et al., 2017; Pettersen, 1984). 이러한 건전한 목재와 비교하였을 때 동림 1−3의 홀로셀룰로오스 함량은 매우 낮지만, 상대적으로 리그닌 함량은 매우 높은 것을 알 수 있다. 여기서 리그닌 함량의 증가는 다당류인 홀로셀룰로오스의 분해에 따른 상대적인 증가로 해석할 수 있다(Cha et al., 2021). 이러한 결과는 당(sugar)분석 결과에서도 명확히 나타난다(Table 3). Glucan(4.6∼5.7%)을 포함한 활엽수재의 주요 헤미셀룰로오스인 xylan(2.2∼2.8%)의 함량이 동림 1−3 모두에서 현저히 감소하였다. 건전한 동일 속 목재의 glucan 및 xylan 함량은 각각 46∼52%와 12∼15% 정도를 나타내었다(Rowell, 2012). 따라서 3점의 동림 수침고목재 모두는 리그닌보다는 다당류를 집중적으로 분해하는 미생물에 의해 열화된 것으로 판단된다. 이 같은 미생물 분해 특징은 일반적으로 침식형 세균 피해를 받은 수침고목재에서 나타나는 현상으로(Gelbrich et al., 2008; Pedersen et al., 2021), 우리나라 해양에서 인양된 신안선, 영흥도선, 진도선, 완도선 등에서도 유사한 경향이 관찰되었다(Cha, 2017; Kim, 1990a, 1993; Kim, 1990b). 침식형 세균과 더불어 연부후균 또한 화학적으로 다당류를 주로 분해하는 특징을 보이기 때문에 전술한 화학적 변화가 연부후균에 의해서도 발생할 수 있다. 다만, 연부후균은 리그닌도 일부 분해할 수 있는 것으로 알려져 있어 홀로셀룰로오스와 리그닌의 상대적 함량비에 있어 침식형 세균과 차이를 보일 수 있다(Daniel and Nilsson, 1998). 종합해보면 동림 1−3 수침고목재는 침식형 세균이나 연부후균, 혹은 두 균의 조합에 의해 분해된 것으로 판단된다.
3.3. 미생물 분해 양태
활엽수재의 기본 세포인 목섬유(wood fiber)의 세포벽 구조(cell wall structure) 변화를 관찰하여 동림 1−3 수침고목재의 미생물 분해 양태를 조사하였다. Figure 1은 건전한 단풍나무(Acer palmatum)의 만재(latewood, LW)를 구성하는 목섬유의 세포벽 구조를 나타내고 있다. 목섬유는 침엽수재를 구성하는 가도관(tracheid)과 함께 표준세포벽 구조를 갖는 세포로 정상적인 환경에서 자란 활엽수재라면 수종이나 부위(조재, 만재)에 관계없이 동일한 세포벽 구조를 나타낸다. 목섬유는 외측부터 순차적으로 1차벽(primary cell wall, PW)과 2차벽(secondary cell wall, SW)으로 구성되어 있으며, 2차벽은 다시 외층(S1), 중층(S2), 내층(S3)으로 구분된다. S3층 안쪽으로는 빈 공간인 세포내강(cell lumen)이 위치한다. 인접하는 목섬유 상호는 중간층(middle lamella, ML)으로 접합되어 있으며, 경우에 따라서는 중간층과 1차벽의 구별이 어려우므로 둘을 합쳐서 복합세포간층(compound middle lamella)이라고 할 때도 있다.
전술한 활엽수재 목섬유의 세포벽 구조를 바탕으로 광학현미경 관찰을 수행한 결과 동림 1−3 모두는 미생물에 의해 매우 심하게 분해된 것을 확인할 수 있었다. Figure 2은 미생물에 의한 목섬유 세포벽의 분해를 보여주고 있다. 동림 1−3 모두에서 리그닌 농도가 가장 높은 중간층에서의 분해는 관찰되지 않았다. 반면, 셀룰로오스나 헤미셀룰로오스와 같은 다당류의 함량이 상대적으로 높은 2차벽은 심각하게 분해되었다. 이러한 분해 특징은 동림 1−3 모두가 리그닌보다는 다당류를 집중적으로 분해하는 미생물에 의해 열화 되었다는 것을 의미하는 것으로 위의 화학분석 결과와도 그 궤를 같이한다.
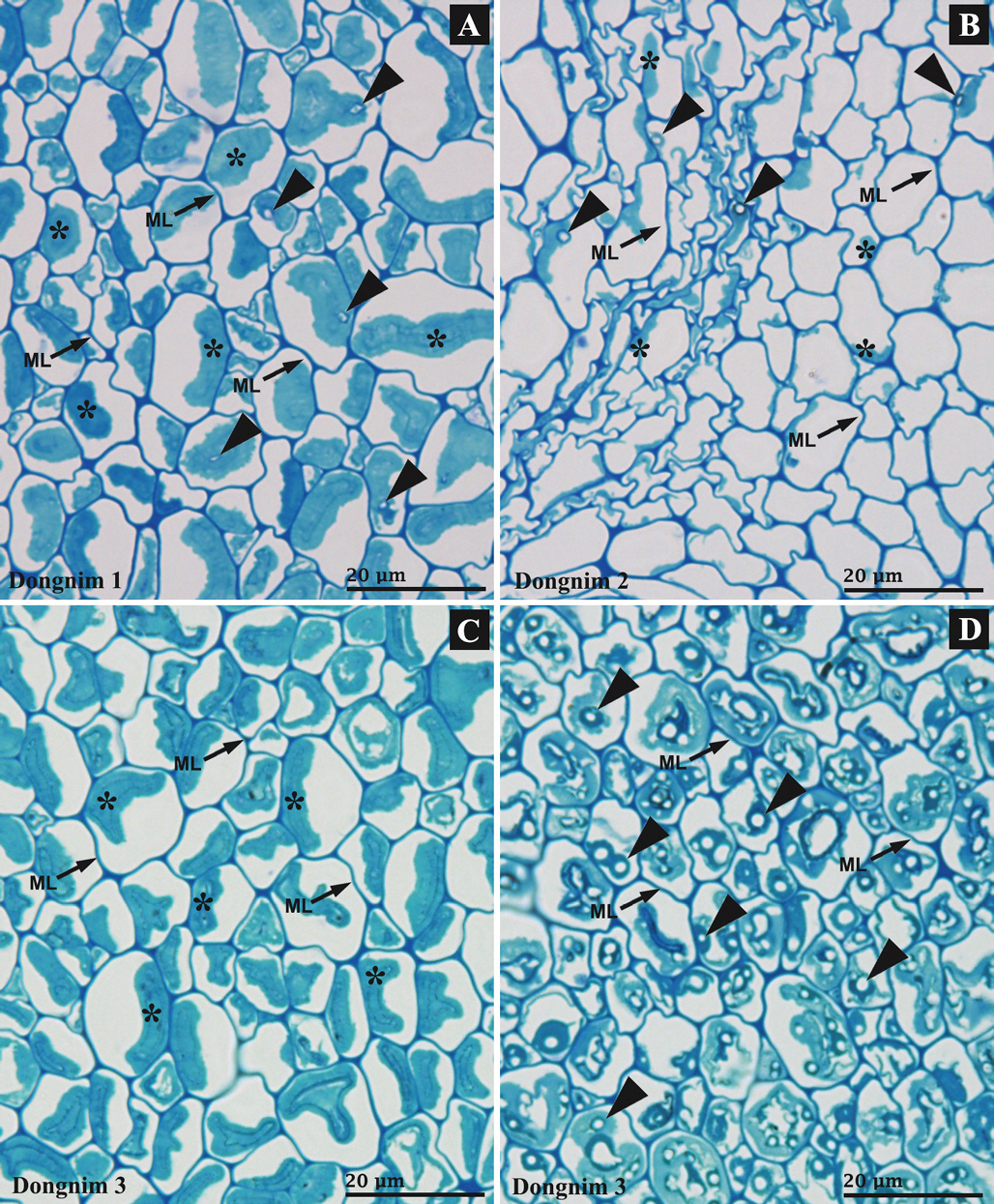
Microbial degradation of wood fibers in Dongnim waterlogged archaeological wood. Dongnim 1 (A), Dongnim 2 (B) and Dongnim 3 (C, D) showing severe degradation of secondary cell wall, with the presence of condensed cell wall residuals (asterisks in A−C) and soft rot cavities (arrowheads in A, B, D). The amount of cell wall residuals in Dongnim 2 (B) was significantly lower than in Dongnim 1 (A) and 3 (C, D). Note almost intact structure of middle lamella (ML) despite the heavy degradation of the secondary cell wall (A−D).
동림 1과 3에서는 분해된 목섬유의 2차벽이 중간층에서 분리되어(delamination) 응축된 형태로 관찰되었다(asterisks in Figure 2A, C). 그러나 동림 2에서는 일부 목섬유에서만 응축된 2차벽이 관찰되었고 대부분의 목섬유에서는 2차벽이 완전히 소실되어 관찰되지 않았다(asterisks in Figure 2B). 또한 동림 2의 특정 부분에서는 목섬유의 모양이 매우 심각하게 변형되어 관찰되었다(Figure 2B). 이 같은 해부학적 차이는 동림 2의 열화 정도가 동림 1과 3에 비해 높기 때문으로 판단된다. 최대함수율 및 화학 분석 결과에서도 동림 2는 동림 1과 3에 비해 높은 열화 정도를 나타내었다(Tables 2, 3).
미생물 분해 양태(decay type)와 관련하여 동림 1−3 모두에서 두 가지 유형이 관찰되었다. 첫 번째는 침식형 세균에 의한 분해이다. 앞에서 서술한 바와 같이 동림 1과 3, 그리고 일부 동림 2 목섬유에서는 2차벽의 분해 잔류물(residual)이 중간층에서 분리되어 응축된 형태로 관찰되었다(asterisks in Figure 2A−C). 그리고 중간층 분해는 동림 1−3 모두에서 관찰되지 않았다(Figure 2A−C). 이러한 분해 양태는 일반적으로 침식형 세균 피해를 받은 수침고목재에서 관찰된다(Björdal, 2012; Cha et al., 2021; Singh et al., 2022). 침식형 세균은 다당류의 구성비가 높은 수침고목재의 2차벽을 집중적으로 분해하고 리그닌 농도가 높은 중간층은 분해하지 않는다(Björdal, 2012; Cha et al., 2021; Singh et al., 2022). 아울러 분해된 2차벽은 다당류의 분해 후 남겨진 리그닌이나 리그닌 유래 물질로 채워진다(Björdal, 2012; Cha et al., 2021; Singh et al., 2022). 동림 2의 경우, 대부분의 목섬유에서 2차벽이 완전히 소실되었기 때문에 다당류와 리그닌 모두를 분해할 수 있는 동굴형 세균에 의한 분해로 판단할 수 있으나, 동굴형 세균의 경우 2차벽뿐만 아니라 중간층도 분해하기 때문에 동굴형 세균 피해로는 볼 수는 없다. 동림 2에서는 2차벽의 소실 여부와 관계없이 중간층 분해는 관찰되지 않았다(Figure 2B). 따라서 동림 2에서의 2차벽 소실은 동굴형 세균에 의한 분해가 아닌 현미경 관찰 시료의 준비 과정에서 발생한 이탈 현상에 의한 것으로 추정되며, 고정처리(fixation)나 알콜 탈수 과정에서 다당류 분해 후 2차벽에 남겨진 리그닌이 세포벽에서 이탈되어 현미경상에서 관찰되지 않았을 가능성이 높다. 이러한 잔류 리그닌의 이탈 현상은 이례적으로 높은 동림 2의 알칼리 추출물 함량(71.2%)에서도 확인할 수 있다(Table 3). 동림 1, 3과 달리 동림 2의 알칼리추출물 안에는 보통의 알칼리추출물 이외에 1% NaOH 용액에 의해 세포벽에서 추출된 잔류 리그닌이 포함되어 함량이 이례적으로 높게 측정되는 것으로 판단된다. 이 같은 현상에 대해서는 추가적인 실험을 통해서 확인할 필요가 있다.
두 번째는 연부후균에 의한 분해이다. 일반적으로 연부후균은 목재세포벽의 2차벽 중층에 동공(cavity)을 형성하여 목재세포벽을 분해하며 수침고목재에서 흔히 관찰된다(Björdal, 2012; Björdal and Dayton, 2020; Blanchette, 2000; Kim and Singh, 2000; Singh et al., 2016, 2019). 동림 1과 2에서는 침식형 세균 분해와 함께 일부 목섬유에서만 간헐적으로 연부후 동공(cavity)이 관찰되었다(arrowheads in Figure 2A, B). 반면, 동림 3에서는 상대적으로 많은 목섬유에서 연부후 피해가 확인되었다(arrowheads in Figure 2D). 동림 3에서의 연부후 발생 정도는 동일한 절편(section)에서 부분에 따라 큰 차이를 나타내었다(Figure 2C vs. 2D).
종합하자면 동림 1−3 수침고목재는 침식형 세균과 연부후균에 의해 공격 받은 것으로 관찰되었다. 일반적으로 알려진 침식형 세균(혐기성)과 연부후균(준혐기성)의 산소 접근성과 관련된 수침고목재의 분해 특성을 고려했을 때 동림 1−3 수침고목재는 매장되어 있던 동안 매장 환경에 변화가 있었을 거라고 예상할 수 있다(Kim and Singh, 2000). 그러나 매장 환경의 변화와 관계없이 매장 전에 일부 부후가 진행된 상태로 저습지에 매장되어 새로운 유형의 미생물 분해가 발생했을 가능성도 있다.
3.4. 미생물 군집 분석
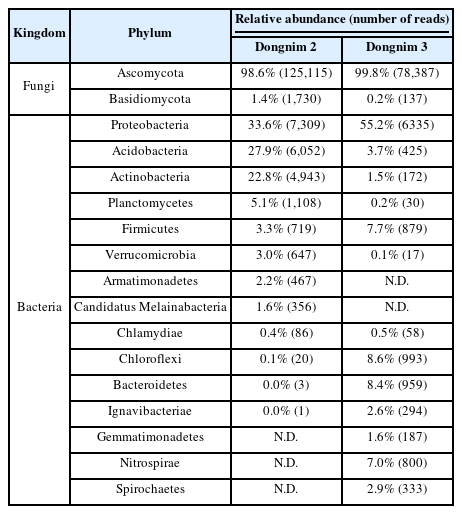
ITS(진균) 및 16S rRNA 유전자(세균) 분석에 기반을 둔 차세대염기서열분석(NGS)을 통해 동림 수침고목재의 미생물 군집을 분석하였다. 동림 1 시료의 경우 NGS분석에 필요한 충분한 양의 DNA가 추출되지 않아 미생물 군집 정보를 얻을 수 없었다. Table 4는 동림 2와 3에서 확인된 미생물 군집을 보여주고 있다. 진균과 세균에 대해 각각 126,845개(동림 2)/78,824(동림 3)개와 21,709개(동림 2)/11,482(동림 3)개의 시퀀싱 리드(reads)를 확보할 수 있었다(Table 4).
3.4.1. 진균 군집 분석
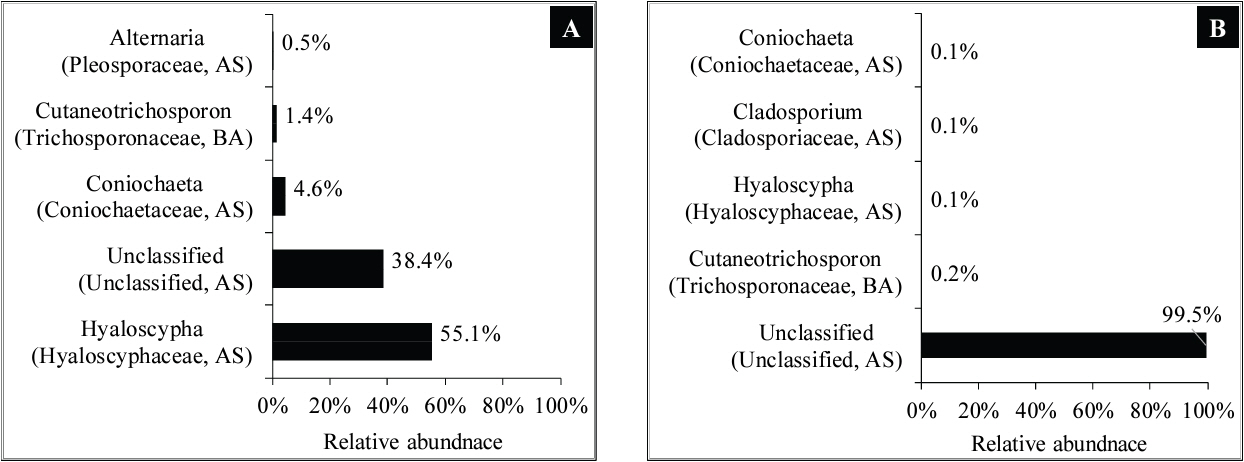
진균 군집 분석 결과, 자낭균문(Ascomycota)이 동림 2와 3에서 각각 98.6%, 99.8%를 차지하였다(Table 4). 일부 담자균문(Basidiomycota)이 검출되었으나 그 비율은 1.4%(동림 2)와 0.2%(동림 3)로 상대적으로 매우 낮았다(Table 4). 이는 동림 2와 3이 함수율이 매우 높은 저습지에서 출토되었고, 출토된 이후에도 지속적으로 물에 침지된 상태로 보관되어 왔기 때문에 호기성이 강한 담자균의 서식이 상대적으로 어려웠기 때문으로 사료된다. 자낭균은 담자균에 비해 상대적으로 수생 환경에 더 잘 견디는 것으로 알려져 있다(Jones and Choeyklin, 2008). 강(class) 수준에서 분석한 결과, Leotiomycetes강이 동림 2와 3에서 각각 93.5%와 99.6%로 군집의 대부분을 차지하였다(Figure 3). 반면에 Sordariomycetes강(4.6%)은 동림 2에서만 검출되었다(Figure 3A).
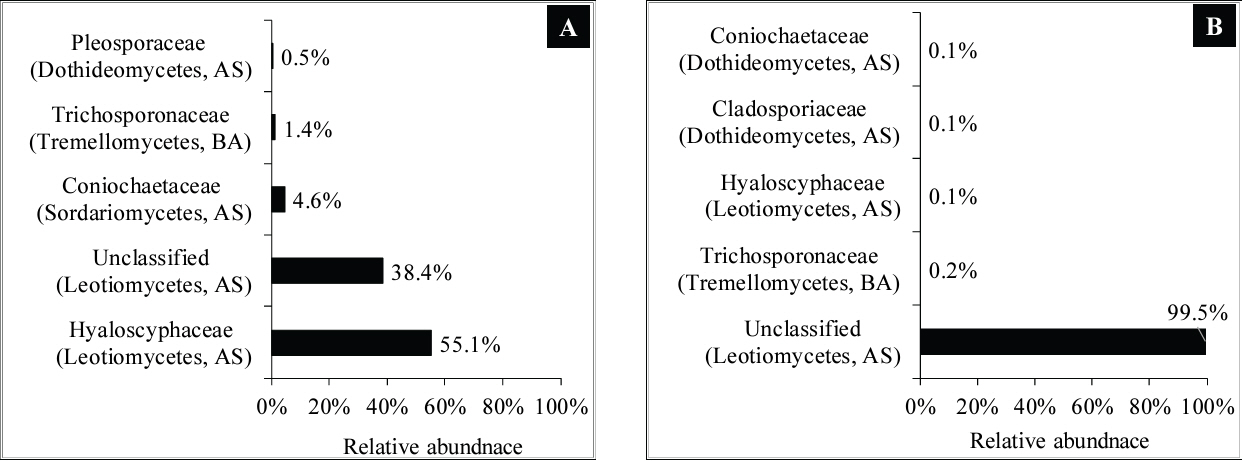
Fungal families in Dongnim 2 (A) and 3 (B) waterlogged archaeological wood. Parenthesis indicates fungal class and phylum, respectively. AS: Ascomycota, BA: Basidiomycota.
과(Family) 수준에서 동림 2에서는 Hyaloscyphaceae과가 55.1%로 가장 우세한 군집으로 검출되었다(Figure 3A). 동림 3의 경우 Leotiomycetes강의 미분류 군집이 99.5%로 대부분을 차지하였다(Figure 3B). 흥미롭게도 동림 2에서는 Hyaloscyphaceae과가 55.1%로 가장 우세한 군집으로 검출되었으나(Figure 3A), 동림 3에서는 0.1%로 매우 낮은 비율을 차지하였다(Figure 3B).
동림 2와 3의 진균 군집 차이는 속(genus) 수준에서도 확인되었다(Figure 4). 동림 2에서는 Hyaloscypha속이 55.1%로 가장 우세한 군집을 차지하였으나(Figure 4A), 동림 3에서는 0.1%로 매우 낮은 비율을 나타내었다(Figure 4B). 이 같은 결과는 동림 2와 3의 진균 군집에 현저한 차이가 있음을 의미한다. 일반적으로 수침고목재가 매장되어 있던 주위 환경 조건은 미생물의 성장과 활동에 중요한 영향을 준다(Björdal, 2012; Pournou, 2020). 따라서 전술한 동림 2와 3의 진균 군집 차이는 두 수침고목재의 매장환경 차이에 의한 것으로 추정할 수 있다. 자연목인 동림 2와 3은 동일한 동림동 유적에서 발굴되었지만 세부적인 출토 장소는 서로 다르다. 아울러 두 수침고목재의 수종차이(가죽나무속 대비 느릅나무속)에 의해 진균 군집의 차이가 발생했을 가능성도 있다. 식별된 자낭균 중에서는 Conichaeta속, Alternaria속, Cladosporium속 균들이 동림 2와 3의 현미경 관찰에서 확인된 연부후를 일으킬 수 있는 것으로 보고되었다(Björdal, 2012; Bugos et al., 1988).
3.4.2. 세균 군집 분석
세균 군집 분석 결과, 동림 2와 3에서 각각 12문(phylum)과 13문의 군집이 검출되어 진균 군집에 비해 상대적으로 더 복잡한 구조를 보였다(Table 4). 두 수침고목재 모두에서 Proteobacteria문이 각각 33.6%와 55.2%로 가장 우세한 군집으로 나타났다(Table 4). 그러나 Proteobacteria문을 제외한 다른 군집에 있어서는 동림 2와 3 사이에 큰 차이를 보였다. 동림 2의 경우 Acidobacteria문(27.9%)과 Actinobacteria문(22.8%)이 Proteobacteria문 다음으로 가장 높은 비율을 나타내었으나, 동림 3에서는 Chloroflexi문(8.6%)과 Bacteroidetes문(8.4%)이 두 번째와 세 번째를 차지하였다(Table 4). 동림 3에서 Acidobacteria문과 Actinobacteria문은 각각 3.7%와 1.5%로 동림 2에 비해 매우 낮은 비율을 차지하였으며, 반대로 동림 2에서는 Chloroflexi문(0.1%)과 Bacteroidetes문(0.0%)이 동림 3에 비해 매우 낮은 비율로 검출되었다(Table 4).
과(Family) 수준에서 분석한 결과, 동림 2와 동림 3에서 각각 49과와 72과의 군집이 검출되었다. 동림 2에서는 2개의 미분류군을 포함한 18과가 1% 이상의 상대적 분포도(relative abundance)를 나타내었으며, Bryobacteraceae과가 16.6%로 가장 우세한 군집으로 검출되었다(Figure 5A). 동림 3은 2개의 미분류군을 포함한 23과가 1% 이상의 분포도를 보였다(Figure 5B). 동림 2와 달리 동림 3에서는 Caulobacteraceae과(9.0%)가 가장 우세한 군집을 차지하였다(Figure 5B). 나머지 1% 이상의 분포도를 나타낸 군집에서도 동림 2와 동림 3사이에 현저한 차이를 보였다(Figure 5).

Bacterial families with relative abundance more than 1% in Dongnim 2 (A) and 3 (B) waterlogged archaeological wood.
속(genus) 수준에서는 동림 2와 3에서 각각 66속과 103속의 군집이 검출되었다. 상대적 분포도 1% 이상을 차지하는 군집은 Figure 6과 같다. 동림 2와 3에서 각각 20속과 27속이 이에 해당되었다. 동림 2에서는 Paludibaculum속이 16.6%로 가장 우세하였으며, Methylovirgula속(14.1%), Aciditerrimonas속(11.4%), Granulicella속(9.0%), Actinomadura속(5.5%), Lamia속(5.2%), Metallibacterium속(5.0%)이 분포도 5%이상을 차지하였다(Figure 6A). 반면에 동림 3에서는 Phenylobacterium속(7.7%), Pseudolabrys속(7.0%), Thermodesulfovibrio속(6.7%), Dehalogenimonas속(6.4%), Carboxylicivirga속(5.9%), Bradyrhizobium속(5.5%)이 5%이상을 차지하여 동림 2와 큰 차이를 나타내었다(Figure 6B). 분포도 5% 미만의 군집에서도 동림 2와 3사이에 큰 차이가 나타났다(Figure 6). 결과적으로, 동림 2와 3은 세균 군집 구조 및 다양성면에서 현저한 차이를 나타내었다. 진균 군집에서 전술한 바와 같이 세균 군집의 차이는 두 수침고목재의 매장환경이나 수종차이 등에 의해 발생했을 것으로 추정된다.

Bacterial genera with relative abundance more than 1% in Dongnim 2 (A) and 3 (B) waterlogged archaeological wood.
분자생물학적 기법의 발달과 함께 수침고목재에 서식하는 많은 세균들이 검출되었다(Antonelli et al., 2020; Landy et al., 2008; Li et al., 2018; Liu et al., 2018; Preston et al., 2012). 대표적으로 Acidiphilium속, Aerosakkonema속, Alicyclobacillus속, Aquiflexum속, Azoarcus속, Bacillus속, Cytophaga속, Diaphorobacte속, Flavobacterium속, Gracilibacillus속, Halomonas속, Idiomarina속, Marinobacter속, Marinomonas속 등이 가장 두드러지는 군집으로 검출되었다. 그러나 검출된 세균들이 수침고목재의 열화 과정에서 정확히 어떠한 역할을 하는지에 대한 정보는 여전히 많지 않다(Pournou, 2020; Singh et al., 2022). 이러한 점에서 본 연구에서도 검출된 세균 군집이 동림 2와 3의 미생물 열화 과정에서 어떤 역할을 하는지 명확히 규정지을 수는 없었다. 다만, 위의 선행연구에서 검출된 세균 군집과 동림 2와 3에서 검출된 세균 군집 간에는 뚜렷한 차이가 있다는 점을 확인할 수 있었다. 이러한 차이는 전술한 바와 같이 매장 환경이나 보관 조건, 목재 수종 등의 차이에 의해 발생한 것으로 추정된다(Björdal, 2012).
4. 결 론
최대함수율 변화를 기준으로 광주광역시 동림동 유적의 저습지에서 발굴된 3점의 활엽수 수침고목재(동림 1−3)는 미생물에 의해 광범위하게 분해된 것을 알 수 있었다. 수침고목재의 최대함수율 증가는 매장 기간과 상관관계는 없는 것으로 확인되었으며, 목재수종 및 매장환경 등 여러 복합적인 요소들에 영향을 받는 것으로 판단된다. 건전한 최근재와 비교하여 동림 1−3의 회분 및 온수 추출물 함량은 증가한 반면 유기용매추출물 함량은 감소하였다. 알칼리추출물 함량은 동림 2에서만 뚜렷한 증가가 확인되었다. 홀로셀룰로오스 함량은 크게 감소하고 리그닌 함량은 상대적으로 크게 증가하였다. 기 보고된 우리나라 해양에서 출수된 고선박 수침고목재의 화학적 특징과 비교한 결과 회분 및 홀로셀룰로오스, 리그닌 함량 변화는 유사한 경향성을 보였다. 반면 추출물 함량의 경우는 고선박 수침고목재간의 변이로 인해 뚜렷한 상관관계를 확인할 수 없었다. 현미경 관찰 결과 동림 1−3 모두에서 리그닌보다는 다당류를 집중적으로 분해하는 침식형 세균과 연부후균 피해가 관찰되어 화학분석 결과와 그궤를 같이하였다. 이는 화학적 분석을 통해서 수침고목재 세포벽의 분해 유형에 대해 어느 정도 예측이 가능하다는 점을 시사하고 있다. 동림 2와 3을 대상으로 미생물 군집을 분석한 결과 두 수침고목재 모두에서 자낭균문이 진균 군집의 대부분을 차지하였고 세균 군집에서는 Proteobacteria문이 가장 우세한 군집으로 검출되었다. 그러나 전체적으로 검출된 미생물 군집 구성에는 동림 2와 3 사이에 뚜렷한 차이를 나타내었다. 아직까지 우리나라의 저습지에서 수침고목재의 분해에 관련하는 미생물 군집 구조나 다양성에 대한 자세한 정보는 알려져 있지 않다. 향후 다양한 수침고목재의 미생물 군집 분석을 통해 매장 환경 및 분해 유형 추정 등에 활용될 수 있을 것이다.
지금까지 우리나라 해양에서 출수된 수침고목재의 미생물 열화 특성에 대해서는 여러 연구가 발표되었다. 그러나 상대적으로 저습지 출토 수침고목재의 미생물 열화에 대한 연구는 매우 제한적이다. 따라서 본 연구 결과는 우리나라 저습지에서 출토된 수침고목재의 해부학적, 화학적 미생물 열화 특성과 관련 미생물 군집을 이해하는데 도움을 줄 수 있을 것으로 기대된다.
Acknowledgements
이 성과는 정부(과학기술정보통신부)의 재원으로 한국연구재단의 지원을 받아 수행된 연구임(No. NRF-2021R1F1A1063024).